热门推荐
- 精 日本上市佐妥昔单抗(Zolbetuximab),claudin (CLDN)18.2阳性胃癌患者迎来新药
- 精 疾病控制率高达90.9%!KRAS G12C抑制剂出击结直肠癌、非小细胞肺癌!
- 精 重磅!“治愈”肺癌更进一步!ALK抑制剂阿来替尼无病生存率高达93.8%!
- 精 85%患者的病情得到控制!KRAS G12C突变的患者有前景的治疗选择
- 精 HER2阳性实体瘤患者命运将改写!DS-8201再获FDA批准,不限癌种!
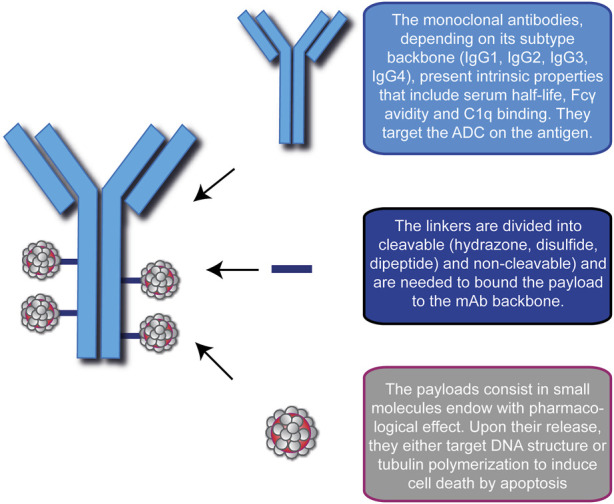
- 精 惊喜!无侵袭性癌生存率达到88.3%,一文读懂15款抗体偶联ADC药物
- 精 复发风险降低60%!特瑞普利单抗注射液再填适应症,我国首个、全球第二个获批的肺癌围手术期疗法
- 精 好消息!21款抗肿瘤药物纳入医保目录!但CAR-T产品无缘此次医保名单!
- 精 NTRK融合让众多实体瘤战栗,成为击败肿瘤的重磅武器
- 精 奥布替尼(Orelabrutinib)广受认可,让更多血液系统肿瘤患者获益
- 精 首款RET抑制剂普拉替尼给非小细胞肺癌患者带来希望
- 精 肿瘤和免疫的关系如何?CAR-T细胞疗法全球上市有9款
- 精 收藏 | 不能错过的胃癌的药物治疗大全!
- 精 KRAS基因靶点药物不间断研究中
- 精 仑伐替尼一种重要的靶向药
- 精 “不完美心动”——干细胞叫嚣“心衰”
- 精 伏美替尼 (Furmonertinib)第三代EGFR-TKI强势来袭
- 精 一文教会你BRCA突变和PAPR抑制剂的关系
- 精 国家药监局批准三款新药上市!!!攻克癌症不再天方夜谭!
- 精 中国首款自主研发的CAR-T细胞治疗伊基奥伦赛注射液获批上市
- 精 培美曲塞
资讯列表
TCR-T是什么细胞TCR-T疗法也是过继细胞转移疗法(ACT)的一种,通过筛选和鉴定能特异性结合靶抗原的TCR序列,利用基因工程改造来自患者外周血的T细胞,然后将改造后的T细胞回输至患者体内,使其能特异性识别并杀伤表达抗原的肿瘤细胞,从而达到治疗肿瘤的目的。是近年来癌症治疗新方法的焦点,这种新型的免疫基因疗法,可以让...
1月29日,国家药品监督管理局药品审评中心(CDE)显示:康方生物自主研发的全球首创双特异性抗体新药依沃西单抗(AK112)拟纳入突破性治疗,联合吉西他滨和顺铂一线治疗晚期胆道癌。
1月29日,国家药品监督管理局药品审评中心(CDE)显示:恒瑞医药申请的HRS-4642注射液拟纳入突破性治疗,用于联合吉西他滨和紫杉醇(白蛋白结合型)用于携带KRAS G12D突变的晚期或转移性胰腺癌的一线治疗。
1月21日,《新英格兰医学杂志》发表了一项突破性临床研究结果:抗体偶联药物(ADC)戈沙妥珠单抗联合帕博利珠单抗一线治疗PD-L1阳性转移性三阴乳腺癌,将患者无进展生存期从7.8个月延长至11.2个月,客观缓解率达到60%,其中13%的患者达到了完全缓解(CR)。更关键的是,对于起效的患者,中位缓解持续时间长达16.5...
1月28日,国家药品监督管理局药品审评中心(CDE)显示:注射用PRO1184拟纳入突破性治疗品种,治疗既往接受过系统性治疗的铂类耐药的上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者。
1月28日,国家药品监督管理局药品审评中心(CDE)显示:注射用瑞康曲妥珠单抗拟纳入优先审评,适用于经奥沙利铂、氟尿嘧啶和伊立替康治疗失败的HER2阳性结直肠癌成人患者。
1月27日,美国食品药品监督管理局(FDA)批准达雷妥尤单抗注射液(Daratumumab)与透明质酸酶 - fihj(hyaluronidase-fihj)联合化疗用于新诊断的多发性骨髓瘤成人,且不符合自体干细胞移植(ASCT)资格。
1月28日,维立志博宣布其基于TCE技术平台LeadsBody®自主研发的具有独特2:1结构和条件性激活的GPRC5D/CD3双特异性抗体LBL-034于2026年1月27日获得美国食品药品监督管理局(FDA)授予快速通道资格认定,用于治疗复发/难治性多发性骨髓瘤(RRMM)。