相关推荐

美国FDA授予CAR-T细胞产品CTD402儿科罕见疾病资格认定
8月29日,北恒生物宣布美国食品药品监督管理局(FDA)已授予其在研通用型CAR-T细胞产品CTD402儿科罕见疾病资格认定(RPDD),用于治疗复发/难治性T细胞急性淋巴细胞白血病和淋巴母细胞淋巴瘤(R/R T-ALL/LBL)。
免疫管家 2025-09-01

超90%的患者肿瘤缩小!CAR-T疗法不仅治血癌,卵巢癌也有效!晚期患者也能实现肿瘤消失
自2017年美国食品药品监督管理局(FDA)批准首个嵌合抗原受体T细胞(CAR-T)疗法以来,CAR-T治疗对于白血病、淋巴瘤和骨髓瘤等某些血癌具有革命性意义。
免疫管家 2025-08-26

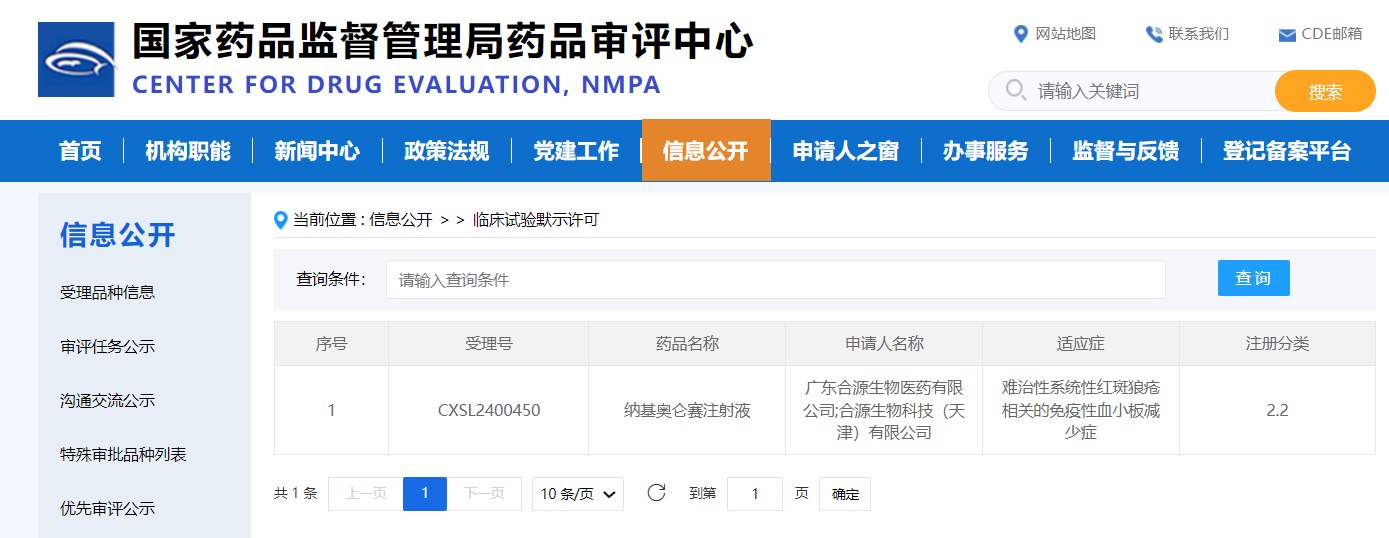
纳基奥仑赛注射液纳入突破性治疗
8月12日,国家药品监督管理局药品审评中心(CDE)显示:合源生物自主研发的源瑞达®(纳基奥仑赛注射液,曾用名:赫基仑赛注射液)纳入突破性治疗,用于治疗儿童复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)。
免疫管家 2025-08-21

国家药监局受理CAR-T细胞产品舒瑞基奥仑赛注射液用于胃癌患者的新药上市申请
6月26日,科济药业宣布,中国国家药品监督管理局(NMPA)已受理舒瑞基奥仑赛注射液(产品编号:CT041,一种靶向Claudin18.2的自体CAR-T细胞产品)的新药上市申请(NDA),用于治疗Claudin18.2表达阳性、至少二线治疗失败的晚期胃/食管胃结合部腺癌(G/GEJA)患者。
免疫管家 2025-06-26

惊!白血病女孩抗癌13年无复发!CAR-T疗法如何精准猎杀癌细胞?
近日,全球首位被CAR-T细胞疗法治愈的白血病儿童——Emily Whitehead在自己的社交媒体上发布了照片,并配文“13 years cancer free yesterday + celebrated being 20 today”。照片中的她笑容灿烂,而这简短的文字背后,是一场持续十余年的生命奇迹。
免疫管家 2025-06-24
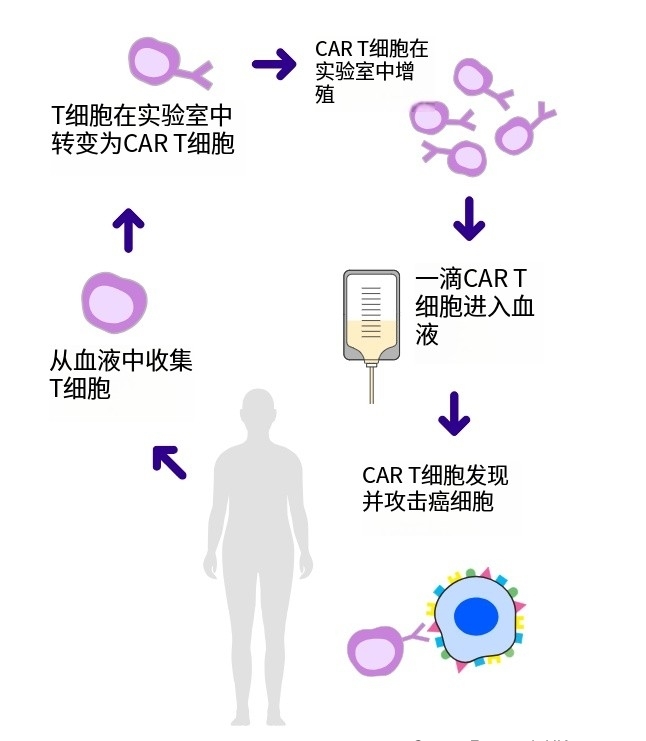
CAR-T细胞产品纳基奥仑赛注射液亮相2025 ASCO和EHA
源瑞达®(纳基奥仑赛注射液,CNCT19,Inaticabtagene Autoleucel Injection)是具有自主知识产权的靶向CD19的CAR-T细胞治疗产品,拥有全球独特的CD19 scFv(HI19a)结构和国际领先的生产制造工艺,先后获得国家药品监督管理局三项新药临床试验许可(IND),用于治疗成人复...
免疫管家 2025-06-17

北恒生物靶向CD19的通用型CAR-T细胞产品RD06-03亮相2025 ASCO
2025年美国临床肿瘤学会(ASCO)年会在美国芝加哥举行。美国临床肿瘤学会(ASCO)是全球规模最大、最具权威性的临床肿瘤会议之一,旨在展示国际最前沿的临床肿瘤学科研进展和治疗成效 。
免疫管家 2025-06-04

huCART19-IL18:复发或难治性淋巴瘤治疗的突破
2025年5月7日,宾夕法尼亚大学佩雷尔曼高级医学中心研究团队在知名医学期刊《新英格兰医学杂志》发表了增强型CAR-T细胞产品(huCART19-IL18)在既往接受过抗CD19 CAR-T细胞治疗的复发或难治性淋巴瘤患者中的临床疗效。这项在宾夕法尼亚大学开展的1期试验共纳入21例接受huCART19-IL18输注的患...
免疫管家 2025-05-27

CAR-T技术进化:全球4.5万癌症患者已接受治疗,病情进展风险直降63%
嵌合抗原受体T细胞疗法(简称CAR-T细胞疗法)是当前个性化癌症治疗领域的前沿技术。2025年,Carl June、Bruce Levine、Isabelle Rivière和Michel Sadelain因开发这一开创性个性化癌症免疫疗法,共同荣获Richard N. Merkin生物医学技术奖。该技术通过改造患者自...
免疫管家 2025-05-27

100%缓解率!CAR-T细胞疗法大爆发!多款产品为癌症患者点亮希望之光
2025年5月7日,宾夕法尼亚大学佩雷尔曼高级医学中心研究团队在知名医学期刊《新英格兰医学杂志》发表了增强型CAR-T细胞产品(huCART19-IL18)在既往抗CD19 CAR-T细胞治疗后复发或难治性淋巴瘤患者中的临床效果。
免疫管家 2025-05-20