热门推荐
- 精 日本上市佐妥昔单抗(Zolbetuximab),claudin (CLDN)18.2阳性胃癌患者迎来新药
- 精 疾病控制率高达90.9%!KRAS G12C抑制剂出击结直肠癌、非小细胞肺癌!
- 精 重磅!“治愈”肺癌更进一步!ALK抑制剂阿来替尼无病生存率高达93.8%!
- 精 85%患者的病情得到控制!KRAS G12C突变的患者有前景的治疗选择
- 精 HER2阳性实体瘤患者命运将改写!DS-8201再获FDA批准,不限癌种!
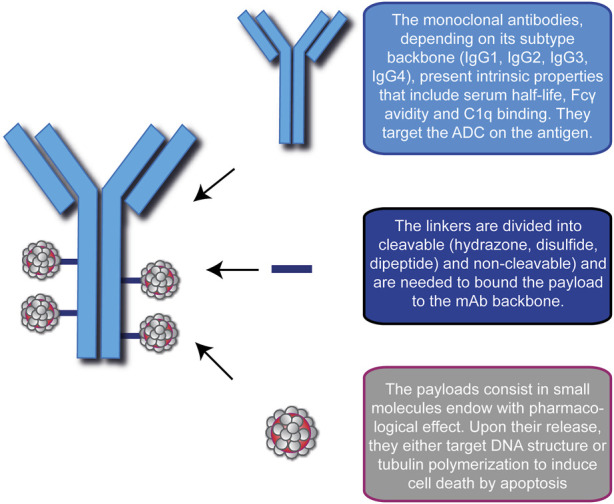
- 精 惊喜!无侵袭性癌生存率达到88.3%,一文读懂15款抗体偶联ADC药物
- 精 复发风险降低60%!特瑞普利单抗注射液再填适应症,我国首个、全球第二个获批的肺癌围手术期疗法
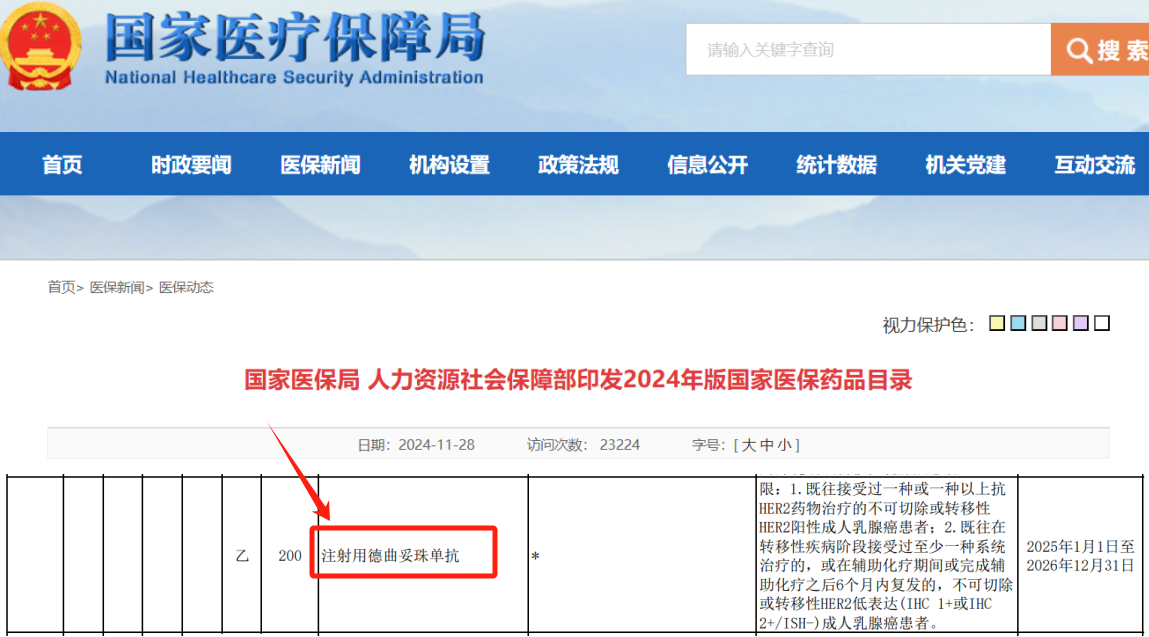
- 精 好消息!21款抗肿瘤药物纳入医保目录!但CAR-T产品无缘此次医保名单!
- 精 NTRK融合让众多实体瘤战栗,成为击败肿瘤的重磅武器
- 精 奥布替尼(Orelabrutinib)广受认可,让更多血液系统肿瘤患者获益
- 精 首款RET抑制剂普拉替尼给非小细胞肺癌患者带来希望
- 精 肿瘤和免疫的关系如何?CAR-T细胞疗法全球上市有9款
- 精 收藏 | 不能错过的胃癌的药物治疗大全!
- 精 KRAS基因靶点药物不间断研究中
- 精 仑伐替尼一种重要的靶向药
- 精 “不完美心动”——干细胞叫嚣“心衰”
- 精 伏美替尼 (Furmonertinib)第三代EGFR-TKI强势来袭
- 精 一文教会你BRCA突变和PAPR抑制剂的关系
- 精 国家药监局批准三款新药上市!!!攻克癌症不再天方夜谭!
- 精 中国首款自主研发的CAR-T细胞治疗伊基奥伦赛注射液获批上市
- 精 培美曲塞
资讯列表
欧洲肿瘤内科学会(ESMO)是全球首屈一指的肿瘤学盛会,汇聚了来自世界各地的临床医生、研究人员、患者倡导者、媒体记者及医疗行业专业人士。2025年ESMO年会于10月17日至21日在德国柏林举行,展示了突破性的研究发现、前沿的治疗手段。此次会议上公布了SG401(Trop2 ADC)一线治疗转移性三阴性乳腺癌的最新临床...
肿瘤一直是威胁人类健康的重大疾病,传统的肿瘤治疗方法如手术、化疗、放疗等虽然在一定程度上能够控制肿瘤的生长和扩散,但也存在着诸多局限性。随着生物技术的不断发展,抗体偶联药物(ADC)应运而生,为肿瘤治疗带来了新的希望。
欧洲肿瘤内科学会(ESMO)是全球首屈一指的肿瘤学盛会,汇聚了来自世界各地的临床医生、研究人员、患者倡导者、媒体记者及医疗行业专业人士。2025年ESMO年会于10月17日至21日在德国柏林举行,展示了突破性的研究发现、前沿的治疗手段。此次会议上公布了轩竹生物自主研发的新型CDK4/6抑制剂吡洛西利在HR+/HER2-...
10月23日,和铂医药公布其新一代全人源仅重链抗CTLA-4抗体普鲁苏拜单抗(HBM4003)联合替雷利珠单抗治疗微卫星稳定型(MSS)转移性结直肠癌(mCRC)的II期临床积极数据。
欧洲肿瘤内科学会(ESMO)是全球首屈一指的肿瘤学盛会,汇聚了来自世界各地的临床医生、研究人员、患者倡导者、媒体记者及医疗行业专业人士。2025年ESMO年会于10月17日至21日在德国柏林举行,展示了突破性的研究发现、前沿的治疗手段。此次会议上公布了恒瑞医药ADC创新药瑞康曲妥珠单抗(SHR-A1811)对比吡咯替尼...
欧洲肿瘤内科学会(ESMO)是全球首屈一指的肿瘤学盛会,汇聚了来自世界各地的临床医生、研究人员、患者倡导者、媒体记者及医疗行业专业人士。2025年ESMO年会于10月17日至21日在德国柏林举行,展示了突破性的研究发现、前沿的治疗手段。此次会议上公布了安罗替尼(小分子多靶点受体酪氨酸激酶抑制剂)、派安普利单抗(PD-1...
近日,2025年欧洲肿瘤内科学会(ESMO)年会在德国柏林召开。此次会议上发布了泽璟制药自主研发的新药Alveltamig(代号:ZG006)、Nilvanstomig(代号:ZG005)的临床研究数据及最新进展。