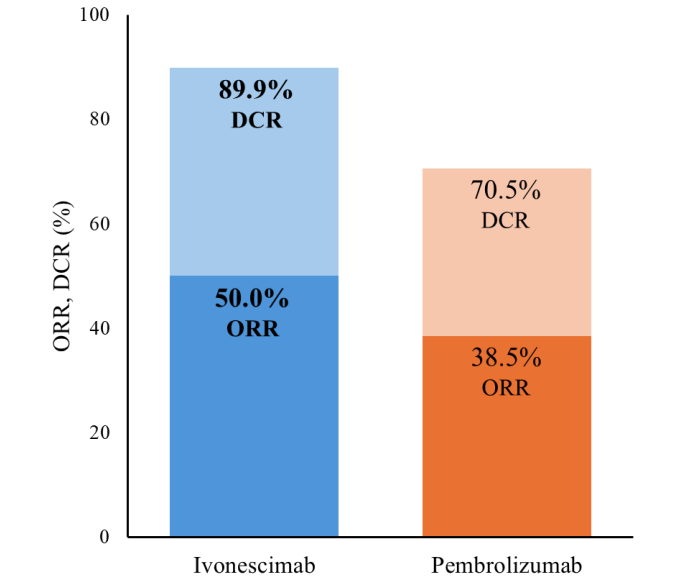
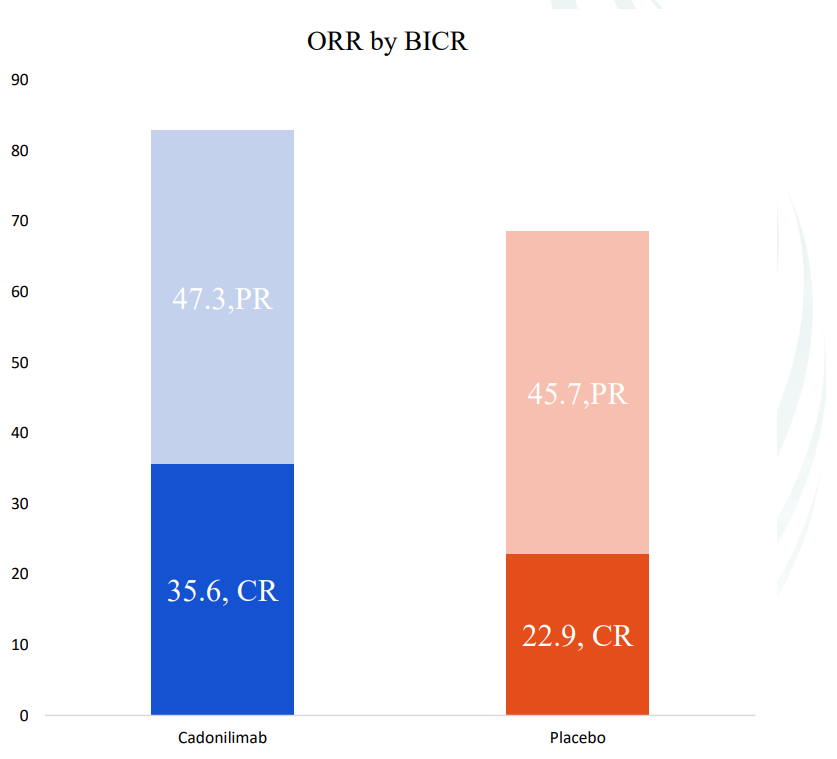
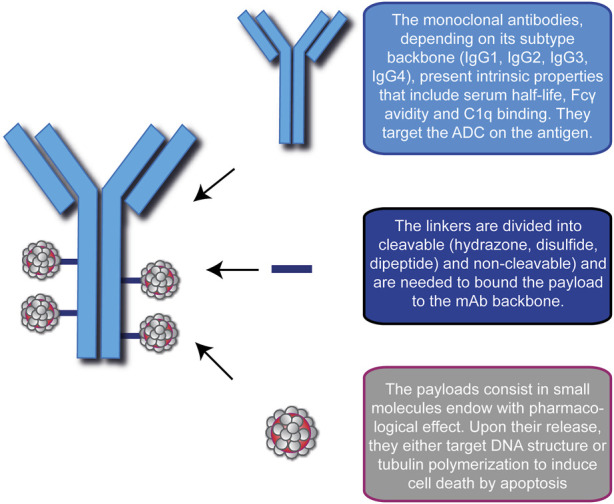
热门推荐
- 精 日本上市佐妥昔单抗(Zolbetuximab),claudin (CLDN)18.2阳性胃癌患者迎来新药
- 精 疾病控制率高达90.9%!KRAS G12C抑制剂出击结直肠癌、非小细胞肺癌!
- 精 重磅!“治愈”肺癌更进一步!ALK抑制剂阿来替尼无病生存率高达93.8%!
- 精 85%患者的病情得到控制!KRAS G12C突变的患者有前景的治疗选择
- 精 HER2阳性实体瘤患者命运将改写!DS-8201再获FDA批准,不限癌种!
- 精 惊喜!无侵袭性癌生存率达到88.3%,一文读懂15款抗体偶联ADC药物
- 精 复发风险降低60%!特瑞普利单抗注射液再填适应症,我国首个、全球第二个获批的肺癌围手术期疗法
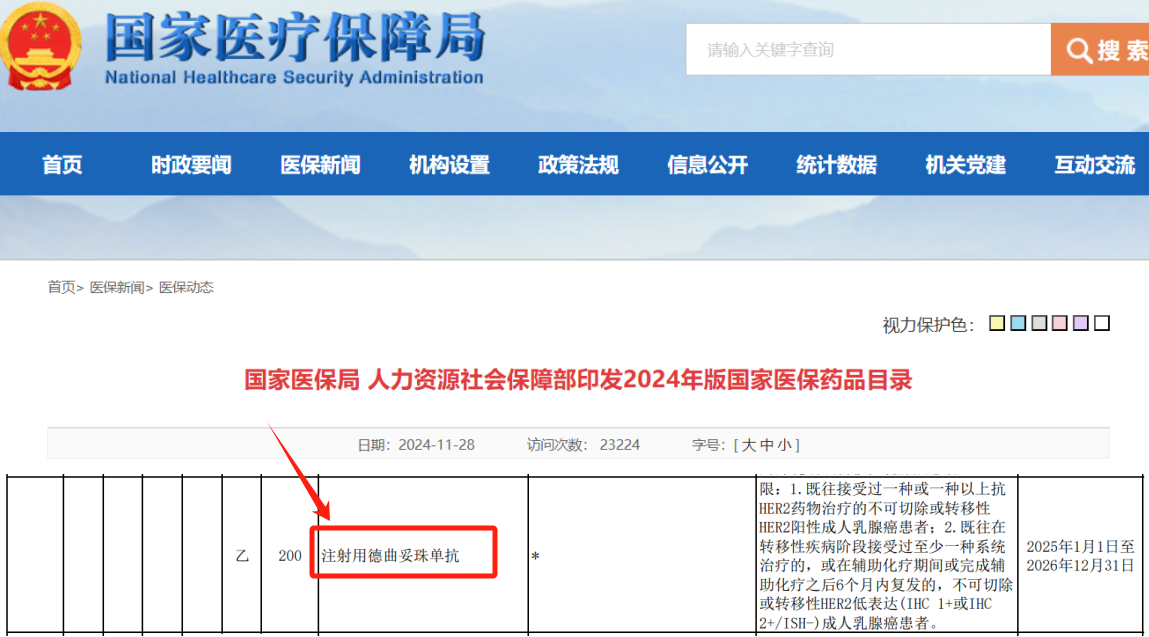
- 精 好消息!21款抗肿瘤药物纳入医保目录!但CAR-T产品无缘此次医保名单!
- 精 NTRK融合让众多实体瘤战栗,成为击败肿瘤的重磅武器
- 精 奥布替尼(Orelabrutinib)广受认可,让更多血液系统肿瘤患者获益
- 精 首款RET抑制剂普拉替尼给非小细胞肺癌患者带来希望
- 精 肿瘤和免疫的关系如何?CAR-T细胞疗法全球上市有9款
- 精 收藏 | 不能错过的胃癌的药物治疗大全!
- 精 KRAS基因靶点药物不间断研究中
- 精 仑伐替尼一种重要的靶向药
- 精 “不完美心动”——干细胞叫嚣“心衰”
- 精 伏美替尼 (Furmonertinib)第三代EGFR-TKI强势来袭
- 精 一文教会你BRCA突变和PAPR抑制剂的关系
- 精 国家药监局批准三款新药上市!!!攻克癌症不再天方夜谭!
- 精 中国首款自主研发的CAR-T细胞治疗伊基奥伦赛注射液获批上市
- 精 培美曲塞
资讯列表
7月11日,国家药品监督管理局(NMPA)批准亚盛医药自主研发的新型Bcl-2选择性抑制剂利生妥®(利沙托克拉,APG-2575)上市,用于既往经过至少包含布鲁顿酪氨酸激酶(BTK)抑制剂在内的一种系统治疗的成人慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)患者。这意味着国产原创利生妥®成为中国首个上市用于治疗...
2025年美国临床肿瘤学会(ASCO)年会在芝加哥隆重召开,作为全球最具影响力的肿瘤学盛会,每年都会吸引来自世界各地的顶尖肿瘤专家、学者、科研人员以及药企代表齐聚一堂。在这里,他们分享最新的研究成果、探讨最前沿的治疗理念,共同推动肿瘤治疗技术的不断进步。此次会议上公布了多项突破性研究。其中,泽璟制药公布了其自主研发的新...
7月8日,国家药品监督管理局药品审评中心(CDE)显示:7月9日,泽璟生物申请的注射用ZG006拟纳入突破性治疗,用于既往经含铂化疗及至少1种其它系统治疗后(三线及以上)复发或进展的晚期小细胞肺癌患者。
7月8日,国家药品监督管理局药品审评中心(CDE)显示:艾力斯医药申请的甲磺酸伏美替尼片拟纳入优先审评,用于既往经含铂化疗治疗时或治疗后出现疾病进展,或不耐受含铂化疗,并且经检测确认存在表皮生长因子受体(EGFR)20外显子插入突变的局部晚期或转移性NSCLC成人患者的治疗。
7月8日,国家药品监督管理局药品审评中心(CDE)显示:百济神州申请的注射用塔拉妥单抗(tarlatamab)拟纳入优先审评,用于既往接受过至少2线治疗(包括含铂化疗)失败的广泛期小细胞肺癌(ES-SCLC)成人患者的治疗。
7月9日,正大天晴1类创新药库莫西利胶囊(CDK2/4/6抑制剂)第2项适应症的上市申请获受理,新增适应症为库莫西利胶囊联合氟维司群注射液用于 HR+/HER2-的局部晚期或转移性乳腺癌患者的初始内分泌治疗。
7月8日,Adcentrx宣布其候选药物ADRX-0405已获美国食品药品监督管理局(FDA)授予孤儿药资格认定,用于治疗胃癌患者。
ADRX-0405是处于临床阶段的新一代抗体偶联药物(ADC),靶向六跨膜上皮抗原1(STEAP1)。STEAP1是一种细胞表面蛋白,在前列腺癌及某些其它癌症中有高表达,但在正...