热门推荐
- 精 日本上市佐妥昔单抗(Zolbetuximab),claudin (CLDN)18.2阳性胃癌患者迎来新药
- 精 疾病控制率高达90.9%!KRAS G12C抑制剂出击结直肠癌、非小细胞肺癌!
- 精 重磅!“治愈”肺癌更进一步!ALK抑制剂阿来替尼无病生存率高达93.8%!
- 精 85%患者的病情得到控制!KRAS G12C突变的患者有前景的治疗选择
- 精 HER2阳性实体瘤患者命运将改写!DS-8201再获FDA批准,不限癌种!
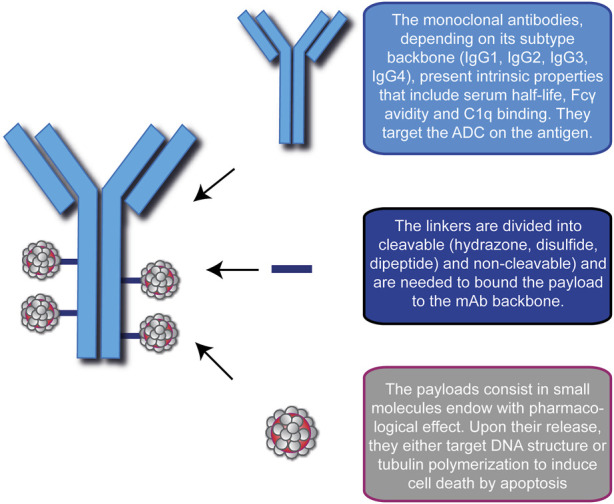
- 精 惊喜!无侵袭性癌生存率达到88.3%,一文读懂15款抗体偶联ADC药物
- 精 复发风险降低60%!特瑞普利单抗注射液再填适应症,我国首个、全球第二个获批的肺癌围手术期疗法
- 精 好消息!21款抗肿瘤药物纳入医保目录!但CAR-T产品无缘此次医保名单!
- 精 NTRK融合让众多实体瘤战栗,成为击败肿瘤的重磅武器
- 精 奥布替尼(Orelabrutinib)广受认可,让更多血液系统肿瘤患者获益
- 精 首款RET抑制剂普拉替尼给非小细胞肺癌患者带来希望
- 精 肿瘤和免疫的关系如何?CAR-T细胞疗法全球上市有9款
- 精 收藏 | 不能错过的胃癌的药物治疗大全!
- 精 KRAS基因靶点药物不间断研究中
- 精 仑伐替尼一种重要的靶向药
- 精 “不完美心动”——干细胞叫嚣“心衰”
- 精 伏美替尼 (Furmonertinib)第三代EGFR-TKI强势来袭
- 精 一文教会你BRCA突变和PAPR抑制剂的关系
- 精 国家药监局批准三款新药上市!!!攻克癌症不再天方夜谭!
- 精 中国首款自主研发的CAR-T细胞治疗伊基奥伦赛注射液获批上市
- 精 培美曲塞
资讯列表
近日,2025年欧洲肿瘤内科学会(ESMO)年会在德国柏林召开。此次会议上发布了维迪西妥单抗联合特瑞普利单抗对比化疗一线治疗HER2表达的局部晚期或转移性尿路上皮癌的Ⅲ期RC48-C016临床研究结果,该研究同步全文在线发表于《新英格兰医学杂志》(NEJM)。
近日,2025年欧洲肿瘤内科学会(ESMO)年会在德国柏林召开。此次会议上发布了君实生物创新产品选择性PI3K-α抑制剂JS105的I期临床研究结果。
近日,2025年欧洲肿瘤内科学会(ESMO)年会在德国柏林召开。此次会议上发布了Beamion LUNG-1 Ib期临床试验数据,该研究评估了宗艾替尼在晚期HER2(ERBB2)突变非小细胞肺癌(NSCLC)的初治患者中的疗效。
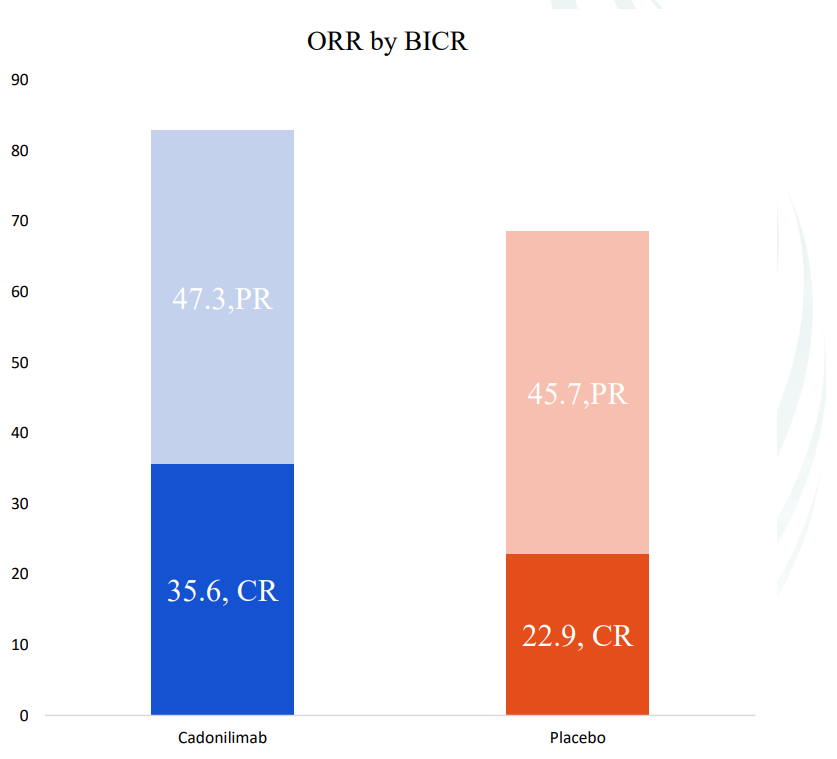
近日,2025年欧洲肿瘤内科学会(ESMO)年会在德国柏林召开。此次会议上发布了康方生物自主研发的全球首创双特异性抗体新药依沃西(PD-1/VEGF双抗)联合化疗,对比替雷利珠单抗联合化疗一线治疗晚期鳞状非小细胞肺癌(sq-NSCLC)的注册性III期临床研究(AK112-306/HARMONi-6)重磅研究结果。该研...
近日,2025年欧洲肿瘤内科学会(ESMO)年会在德国柏林召开。此次会议上公布了德达博妥单抗(Dato-DXd)TROPION-Breast02 Ⅲ期临床研究结果。
2025年欧洲肿瘤内科学会(ESMO)年会在德国柏林盛大召开,作为全球肿瘤领域的重要学术盛会,此次会议公布了众多令人瞩目的研究成果。其中,多款抗体-药物偶联物(ADC)药物的临床数据格外引人注目,为肿瘤治疗领域带来了新的曙光和方向。
10月19日,《新英格兰医学杂志》公布了TROP2 ADC芦康沙妥珠单抗 (sac-TMT) 单药对比培美曲塞联合铂类治疗经EGFR-TKI治疗失败的EGFR突变局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)患者的III期注册临床研究结果(OptiTROP-Lung04)。
近日,2025年欧洲肿瘤内科学会(ESMO)年会在德国柏林召开。此次会议上公布了B7-H4靶向抗体-药物偶联物(ADC)注射用HS-20089用于铂耐药卵巢癌(PROC)患者治疗的Ⅱ期研究结果。