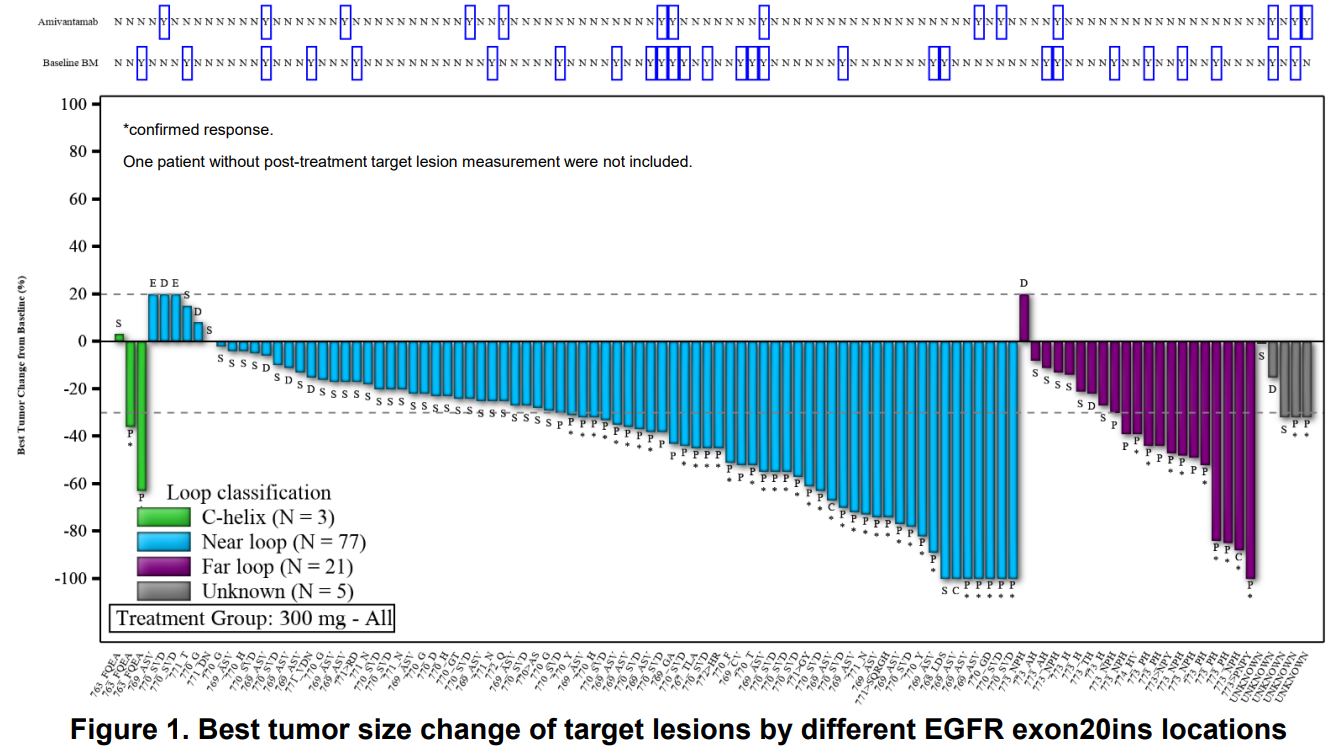
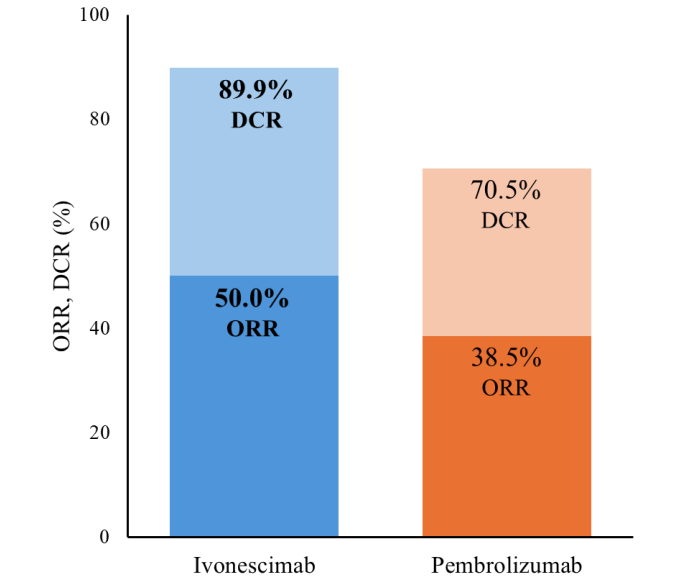
热门推荐
- 精 日本上市佐妥昔单抗(Zolbetuximab),claudin (CLDN)18.2阳性胃癌患者迎来新药
- 精 疾病控制率高达90.9%!KRAS G12C抑制剂出击结直肠癌、非小细胞肺癌!
- 精 重磅!“治愈”肺癌更进一步!ALK抑制剂阿来替尼无病生存率高达93.8%!
- 精 85%患者的病情得到控制!KRAS G12C突变的患者有前景的治疗选择
- 精 HER2阳性实体瘤患者命运将改写!DS-8201再获FDA批准,不限癌种!
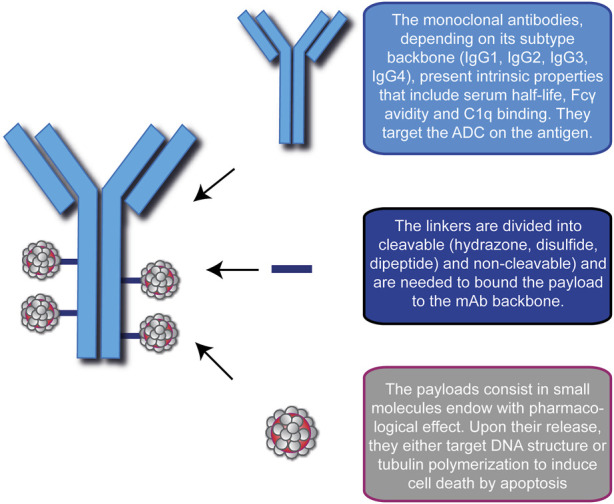
- 精 惊喜!无侵袭性癌生存率达到88.3%,一文读懂15款抗体偶联ADC药物
- 精 复发风险降低60%!特瑞普利单抗注射液再填适应症,我国首个、全球第二个获批的肺癌围手术期疗法
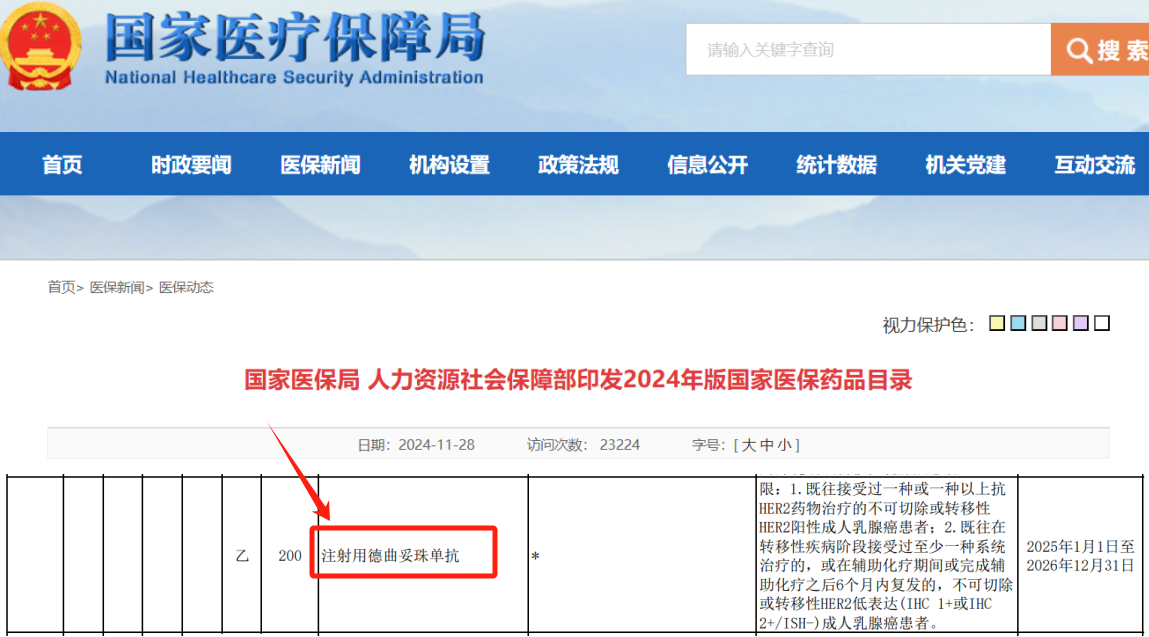
- 精 好消息!21款抗肿瘤药物纳入医保目录!但CAR-T产品无缘此次医保名单!
- 精 NTRK融合让众多实体瘤战栗,成为击败肿瘤的重磅武器
- 精 奥布替尼(Orelabrutinib)广受认可,让更多血液系统肿瘤患者获益
- 精 首款RET抑制剂普拉替尼给非小细胞肺癌患者带来希望
- 精 肿瘤和免疫的关系如何?CAR-T细胞疗法全球上市有9款
- 精 收藏 | 不能错过的胃癌的药物治疗大全!
- 精 KRAS基因靶点药物不间断研究中
- 精 仑伐替尼一种重要的靶向药
- 精 “不完美心动”——干细胞叫嚣“心衰”
- 精 伏美替尼 (Furmonertinib)第三代EGFR-TKI强势来袭
- 精 一文教会你BRCA突变和PAPR抑制剂的关系
- 精 国家药监局批准三款新药上市!!!攻克癌症不再天方夜谭!
- 精 中国首款自主研发的CAR-T细胞治疗伊基奥伦赛注射液获批上市
- 精 培美曲塞
资讯列表
7月30日,美国食品药品监督管理局(FDA)批准达雷妥尤单抗注射液联合硼替佐米、来那度胺和地塞米松用于诱导和巩固治疗符合自体干细胞移植 (ASCT) 条件的新诊断多发性骨髓瘤患者。
7月26日,《Journal of Clinical Oncology》发表了一篇题为“Vebreltinib for Advanced Non–Small Cell Lung Cancer Harboring c-Met Exon 14 Skipping Mutation: A Multicenter, Single...
7月29日,阿斯利康宣布,布鲁顿氏酪氨酸激酶(BTK)抑制剂Calquence(acalabrutinib)联合venetoclax含或不含obinutuzumab治疗初治成人慢性淋巴细胞白血病(CLL)的III期AMPLIFY临床试验的中期分析获得积极结果。与标准化学免疫疗法相比,显著提高了患者无进展生存期(PFS)...
7月23日,BioAtla宣布,美国食品药品监督管理局 (FDA) 已授予 ozuriftamab vedotin 快速通道资格,用于治疗在接受铂类化疗和PD-1/L1免疫检查点抑制治疗后疾病进展的复发或转移性头颈部鳞状细胞癌(HNSCC)患者。
7月26日,基石药业宣布欧盟委员会(EC)已批准舒格利单抗(商品名:Cejemly®)联合含铂化疗用于无EGFR敏感突变, 或无ALK, ROS1, RET基因组肿瘤变异的转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。此次批准标志着舒格利单抗成为全球首个在欧洲上市的、联合化疗一线治疗鳞状和非鳞状NSCLC的PD-...
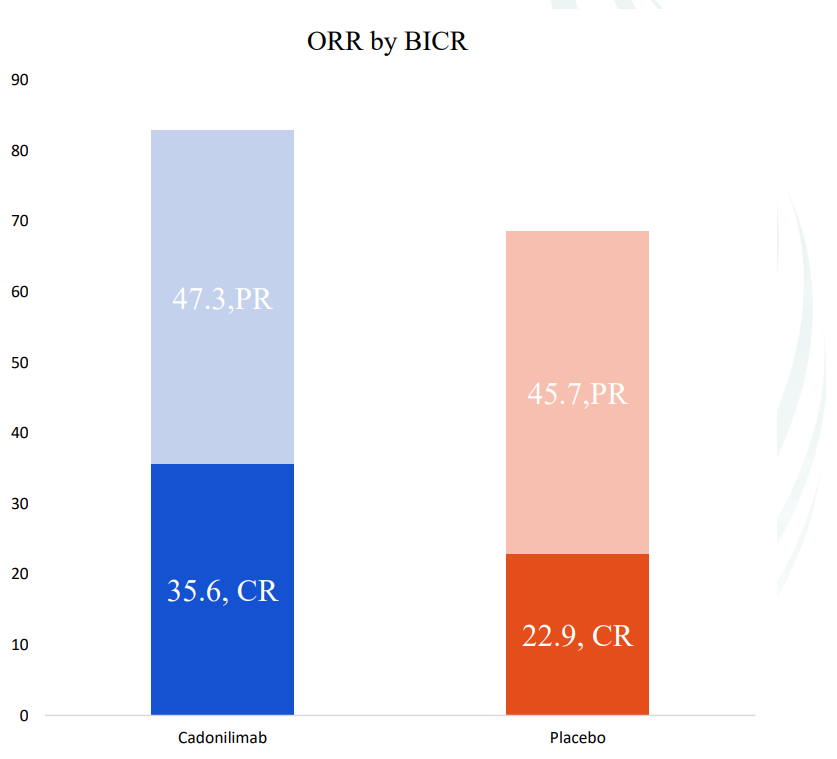
7月30日,康方生物宣布其独立自主研发的PD-1/CTLA-4双抗卡度尼利联合普络西(VEGFR-2单抗)+化疗用于治疗经PD-1/L1抑制剂联合化疗治疗进展的晚期胃腺癌或胃食管结合部腺癌的注册性III期临床研究(AK109-301)已完成首例患者入组。
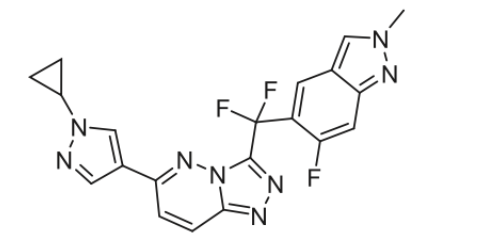
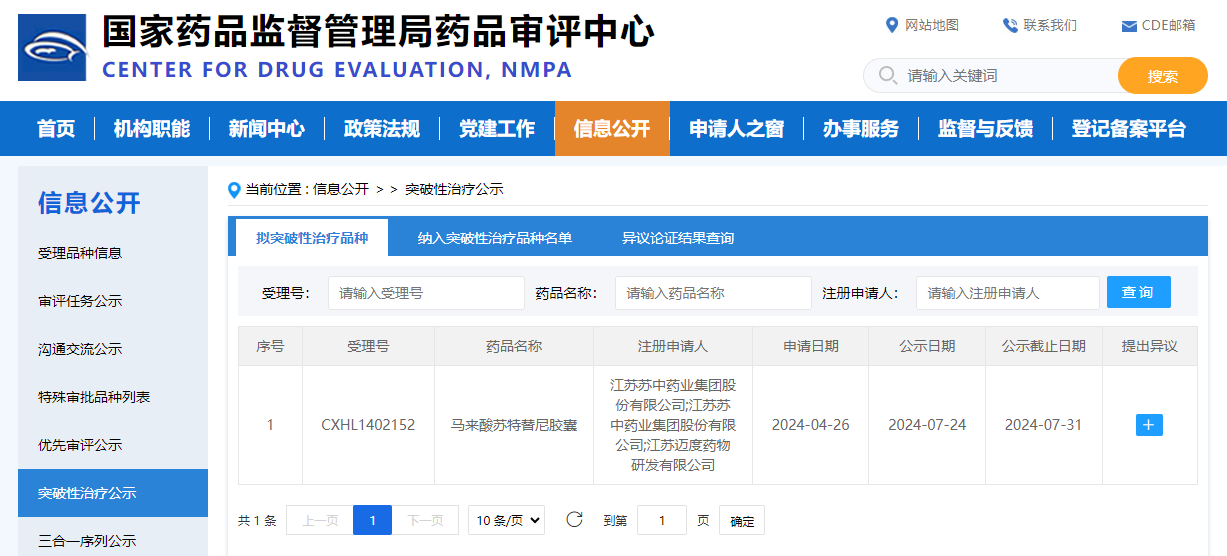
7月24日,国家药监局药品审评中心(CDE)官网显示,拟纳入EGFR酪氨酸激酶抑制剂(EGFR-TKI)马来酸苏特替尼胶囊为突破性治疗品种,适应症为:用于治疗局部晚期或转移性非小细胞肺癌(NSCLC)(仅限非耐药性罕见EGFR突变,包括L861Q、G719X和/或S768I)患者。